#本文仅代表作者观点,不代表IPRdaily立场,未经作者许可,禁止转载#
“本文主要针对中国药品专利链接诉讼第一案案涉专利的无效宣告请求进行分析,以总结该专利为何被宣告无效,以及该无效案件对药品专利申请的启示。”
来源:IPRdaily中文网(iprdaily.cn)
作者:郑佳 广东君龙律师事务所
张巍巍 广东君龙(坪山) 律师事务所

《中华人民共和国专利法》(以下简称“《专利法》”)经过第四次修正,于2021年6月1日正式实施。其中,第七十六条首次设置了药品专利链接制度。根据上述第七十六条的规定,国家知识产权局(以下简称“国知局”)和国家药品监督管理局(以下简称“药监局”)于2021年7月4日发布了《药品专利纠纷早期解决机制实施办法(试行)》(以下简称“《实施办法》”),国知局于2021年7月5日又单独发布了《药品专利纠纷早期解决机制行政裁决办法》,最高人民法院亦于2021年7月5日发布了《最高人民法院关于审理申请注册的药品相关的专利权纠纷民事案件适用法律若干问题的规定》。自此,药品专利链接制度从政策上升到了法律,同时也联动了国知局、药监局和法院。
一般情况下,原研药在其专利有效期内定价高,原研药厂商在该期限内可获得高额利润,但药品专利一旦失效,仿制药就会迅速上市,同时该类药品的市场价格会大幅降低,此时,原研药厂商的利益受到严重影响,而仿制药厂商和公众获益。众所周知,药品的研发周期长、投入大、风险高,如果原研药厂商和仿制药厂商在双方药品上市后再进行专利纠纷的解决,一方或双方会面临巨大损失,而药品专利链接制度就是将专利纠纷前置到仿制药上市审评审批阶段予以解决,即原研药上市时,应在中国上市药品专利信息登记平台登记相关信息;药企在提交仿制药上市申请时,亦在该平台做出声明,根据登记的信息以及声明类型,双方再决定是否通过诉讼或行政手段解决早期纠纷。
第四次修正的《专利法》实施后,受到了医药行业的广泛关注。本文主要针对中国药品专利链接诉讼第一案案涉专利的无效宣告请求进行分析,以总结该专利为何被宣告无效,以及该无效案件对药品专利申请的启示。
关键词:药品专利链接制度 专利无效 药物杂质
一、诉讼案情
日本中外制药株式会社(以下简称“中外制药”)研发的用于治疗骨质疏松的药物“艾地骨化醇软胶囊”(以下简称“涉案原研药”)于2020年12月在中国取得上市许可,该药品在中国的发明专利名称为“ED-71制剂”,专利号为200580009877.6(以下简称“涉案专利”)。根据相关规定,中外制药在中国上市药品专利信息登记平台登记了涉案原研药和涉案专利。
2021年8月16日,浙江温州海鹤药业有限公司(以下简称“海鹤药业”)针对涉案原研药向药监局申请了仿制药上市申请,并作出4.2类声明,即仿制药未落入涉案专利权保护范围。
随后,中外制药依据《实施办法》第七条向北京知识产权法院(以下简称“北知院”)提起诉讼,请求确认海鹤药业申请注册的仿制药技术方案落入涉案专利权利要求1-6的保护范围,北知院于2021年11月8日受理。2021年12月30日,涉案专利被国知局宣告全部无效,但中外制药和海鹤药业均有在涉案仿制药上市前通过本案诉讼解决专利纠纷的意愿,因此,北知院继续审理该案。本案经过两审,最高人民法院于2022年8月5日做出二审判决(案号:(2022)最高法知民终905号):驳回中外制药的上诉,维持原判,即判定海鹤药业的技术方案不落入涉案专利的保护范围[1]。
值得注意的是,上述无效宣告的请求人并不是海鹤药业,而是正大天晴药业集团股份有限公司(以下简称“正大天晴”)和四川国为制药有限公司(以下简称“四川国为”)。之所以中外制药未起诉正大天晴和四川国为,是因为此前正大天晴未提交仿制药上市申请,亦未作出声明,而四川国为此前未做出第4类声明。
二、无效案情
1.药品信息
骨质疏松症(osteoporosis)是由于多种原因导致的骨密度和骨质量下降,骨微结构破坏,造成骨脆性增加,从而容易发生骨折的全身性骨病。艾地骨化醇(eldecalcitol),研发代号为ED-71,系用于治疗骨质疏松症的活性维生素D3衍生物,由罗氏(Roche)旗下的中外制药(Chugai Pharmaceutical)开发,最早于2011年在日本上市,2020年12月11日正式在中国获批上市[2]。
2.涉案专利基本信息
涉案专利的基本信息、无效信息以及原权利要求和修改后的权利要求书如下表1:
表1 涉案专利相关信息
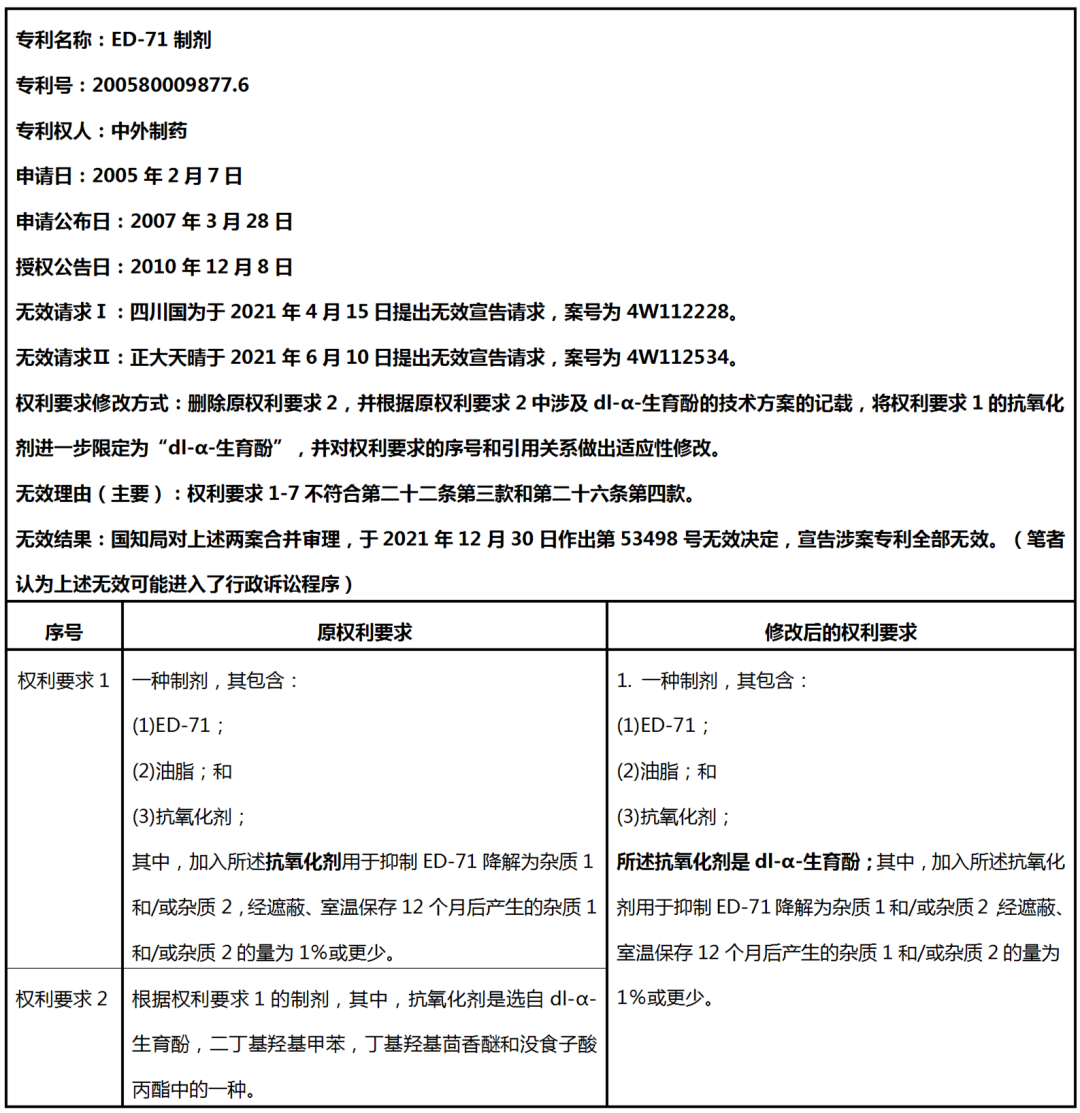
备注:表1以及下文中ED-71系:(5Z,7E)-(1R,2R,3R)-2-(3-羟基丙氧基)-9,10-断胆甾-5,7,10(19)-三烯-1,3,25-三醇;杂质1或速甾醇型杂质系:6E-(1R,2R,3R)-2-(3-羟基丙氧基)-9,10-断胆甾-5(10),6,8(9)-三烯-1,3,25-三醇;杂质2或反式型杂质系:(5E,7E)-(1R,2R,3R)-2-(3-羟基丙氧基)-9,10-断胆甾-5,7,10(19)-三烯-1,3,25-三醇。
本文暂不讨论其他权利要求,即原权利要求3-7。
3.第53498号无效决定要点[3]
对于以储存过程中特定杂质及含量限定的药物制剂产品权利要求,如果发明的实际贡献在于发现了制剂中活性成分在储存过程中降解产生的特定杂质的结构和含量以及提出抑制所述特定杂质的技术手段,但一方面,在未对杂质自身效果进行研究的前提下,特定杂质及其含量所表征的本质仍然是制剂活性成分的纯度和稳定性,另一方面所述抑制特定杂质的技术手段是本领域为了提高制剂活性成分的纯度和稳定性所使用的常规技术手段,本领域技术人员为了使该制剂中活性物质在储存过程中维持较高纯度和足够稳定性,容易想到引入相应技术手段来制备制剂,则该制剂的技术方案是显而易见的。
4.无效争议
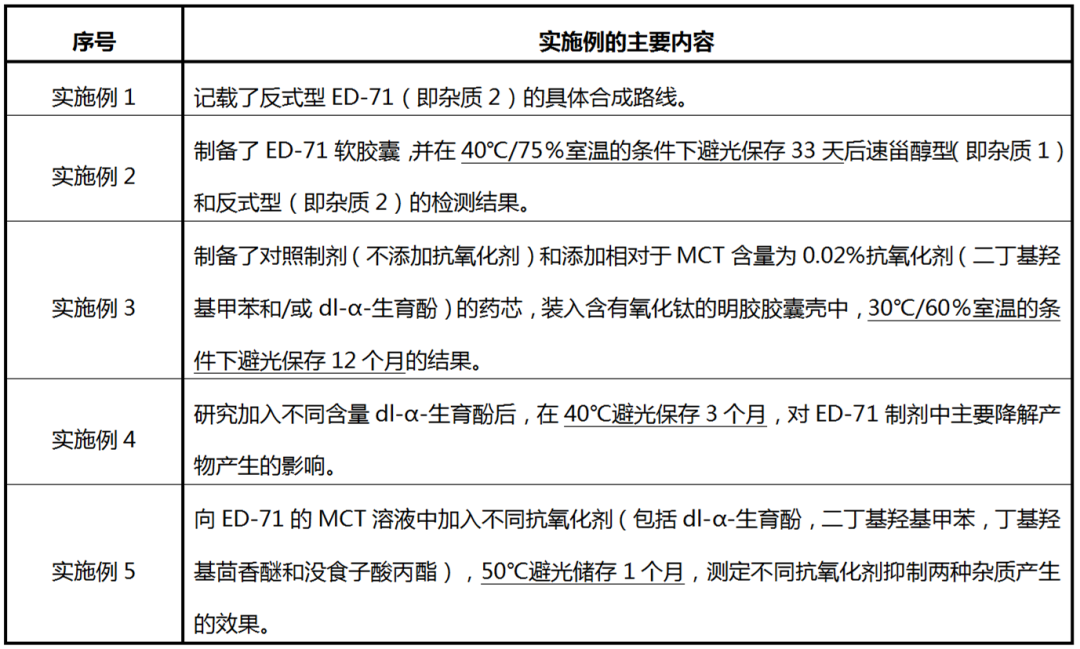
本发明的技术效果主要通过涉案专利说明书5个具体实施例(仅列举5个相关的实施例)来体现,具体如表2所示。
表2 涉案专利的各实施例的主要内容
请求人认为:
(1)涉案专利的实施例1和实施例3的实验过程存在瑕疵;涉案专利的实施例4、5不足以支持权利要求1的技术效果。由于中外制药在口审前对权利要求进行了修改,在口审过程中,请求人明确放弃抗氧化剂种类不支持的无效理由。
(2)权利要求1-7不具备创造性。
合议组认为:
(1)虽然涉案专利说明书实施例的实验数据存在瑕疵或者不一致之处,以及实施例4和实施例5的储存条件与权利要求1的储存条件不完全相同,但从说明书记载内容整体合理,能够确认涉案专利的制剂中,生育酚对制剂存储过程中速甾醇型杂质和反式型杂质产生具有抑制作用。
(2)关于创造性。
证据Ⅱ-3(US6448421B1)中公开了维生素D衍生物的结晶及其制备方法,指出ED-71是维生素D衍生物的一种活性形式,具有骨形成作用并因此可用作骨质疏松治疗剂,即公开了可作为骨质疏松治疗剂的ED-71。
权利要求1与证据Ⅱ-3公开的内容相比,区别在于:权利要求1将ED-71制成药物制剂,制剂中含有油脂和一定量的抗氧化剂dl-α-生育酚。
在确定权利要求的保护范围时,权利要求中的所有技术特征均应当予以考虑,而每一个技术特征的实际限定作用应当最终体现在该权利要求所要求保护的主题上。涉案专利的权利要求1中,除了ED-71、油脂和抗氧化剂dl-α-生育酚外,还限定了“加入所述抗氧化剂用于抑制……(速甾醇型和/或反式型杂质)的量为1%或更少”的技术效果特征。该技术效果特征不是产品权利要求中常见的对组分和含量的直接限定,但是其表明了加入抗氧化剂dl-α-生育酚的量应达到足以抑制两种物质在所述储存条件下含量小于1%的程度,从而隐含了对制剂产品中dl-α-生育酚含量的限定。那么,应该如何评价上述两种杂质对权利要求1的限定作用呢?
首次发现药物储存过程中存在的特定杂质仅属于一种科学发现,除非杂质的存在或其含量导致了制剂活性成分在药理或毒理学发生了较大变化,并由此需要从制剂中特意排除所述杂质,此时用杂质种类和/或含量限定对制剂产品才具有直接和实际的限定作用。本案中,专利权人并未证实ED-71的速甾醇型杂质和/或反式型杂质的特定效果,因而对权利要求1的制剂产品权利要求而言,前述两种储存过程中所产生的特定杂质及其含量的确认仅仅是一种发现,其反映的仍然是制剂中活性成分ED-71的含量,权利要求1所限定的制剂产品的技术效果最终体现在储存稳定性。
根据上述区别特征及其产生的技术效果可以确定,权利要求1相对于证据Ⅱ-3实际解决的技术问题是提供一种储存稳定性较高的ED-71制剂。通过证据Ⅱ-3,本领域技术人员能够合理预期ED-71在长期储存时也应具备维生素D3类药物的储存不稳定性。因此,如果其他证据能够公开或提供技术启示:“利用抗氧化剂抑制杂质来保证制剂的稳定性”,则涉案专利的权利要求1不具备创造性。本案中,权利要求1相对于证据Ⅱ-3结合其他证据不具备创造性。
三、涉案专利无效决定对专利申请的启示
1.在药物制剂稳定性研究过程中涉及杂质研究的专利申请启示
在药物制剂稳定性研究过程中,根据药典的相关规定,研发人员通常会对杂质进行研究,并对杂质的含量进行控制,以实现药品质量的控制。当研发人员在杂质研究中发现一种之前未曾发现过的杂质时,该杂质的种类以及对该杂质含量的限定是否具有申请专利的价值?
具体到本案,涉案专利中的杂质2即为上述情形,即发现了新的杂质。根据涉案专利的无效决定公开的内容,合议组并未否定这种情形的可专利性,但合议组指出,“对于药物制剂中杂质及其含量而言,通常情况下,首次发现药物储存过程中存在的特定杂质仅属于一种科学发现,除非杂质的存在或其含量导致了制剂活性成分在药理或毒理学发生了较大变化,并由此需要从制剂中特意排除所述杂质,此时用杂质种类和/或含量限定对制剂产品才具有直接和实际的限定作用”。由于本案中的杂质对权利要求较小的限定作用,通过其他证据证明“利用抗氧化剂抑制杂质”并不困难,一定程度也影响了涉案专利的稳定性。
因此,研发人员发现新杂质时,可以对该杂质进行进一步的药理或毒理学研究,经过进一步的研究,若发现该杂质使得制剂活性成分在药理或毒理学发生了较大变化,达到了需要从制剂中特意排除或者进行含量控制的地步,则可考虑针对杂质进行相应的专利保护。由于围绕新杂质申请了专利,也可实现药品专利的立体式保护。
2.关于权利要求是否得到说明书支持的启示
如前所述,中外制药与海鹤药业二审判决认定海鹤药业的技术方案不落入专利的保护范围,原因在于,中外制药为了在无效程序中规避《专利法》第二十六条第四款的规定,将权利要求1中的抗氧化剂限缩为dl-α-生育酚。二审法院认为,根据禁止反悔原则不能将侵权技术方案中的其他抗氧化剂等同于dl-α-生育酚,因此判定不侵权。
笔者对比权利要求1和各个实施例发现,涉案专利中的多数实施例确实是围绕dl-α-生育酚展开的,涉及dl-α-生育酚相关的实施例充分体现了权利要求1所描述的技术效果,但涉及其他抗氧化剂相关的实施例并未充分体现权利要求1所描述的技术效果。为了避免《专利法》第二十六条第四款权利要求书得不到说明书支持的问题,中外制药放弃了原权利要求2中的另外3种抗氧化剂的技术方案。
从时间上看,中外制药在无效程序中修改权利要求时,尚未起诉海鹤药业,没有预判到诉讼中的权利要求的保护范围。笔者认为,上述权利要求的修改方案稍显极端。虽然涉案专利说明书中的实施例有一定的瑕疵,但仍存在一定的解释空间;且万一修改前的权利要求被宣告无效,中外制药仍有专利无效行政诉讼的救济途径,而一旦限缩了权利要求,根据禁止反悔原则,中外制药在诉讼中便回天乏术。
我们在进行专利权利要求布局时,应当充分评估说明书实施例中的方案是否能够支持权利要求的上位概括,如果不能,则需要进行相应技术方案的补充。具体到本案,专利权人应在提交专利申请前进一步补充其他3种抗氧化剂在相应条件下的实验数据,并尽可能多地对说明书中列出的其他抗氧化剂提供相应的实验数据。
3.关于专利申请的其他注意事项
首先,关于实验条件,权利要求与说明书应尽可能保持一致,或者至少应当达到:当使用不同条件时,对技术效果可以进行合乎逻辑说理的程度。
涉案专利的权利要求1限定了实验条件,即“经遮蔽,室温保存12个月”,而涉案专利的实施例2-5,4个实施例的实验条件均不相同,其分别为:40℃/75%室温的条件下避光保存33天、30℃/60%室温的条件下避光保存12个月、40℃避光保存3个月、50℃避光储存1个月。
笔者认为,最佳的处理方式是将4个实施例的实验条件与权利要求1的实验条件设置为一致;次优的处理方式则是,参考相关规定,例如《中国药典》2020版通则9001“原料药物与制剂稳定性试验指导原则”中“长期试验”实验条件:“供试品在温度25℃±2℃,相对湿度60%±5%的条件下放置12个月,或在温度30℃±2℃、相对湿度65%±5%的条件下放置12个月”,以及“加速实验”实验条件:“供试品在温度40℃±2℃、相对湿度75%±5%的条件下放置6个月”,以实现合乎逻辑地说理。
其次,在专利申请递交前,应注意充分核对和检查申请文件,尤其是涉及实验数据的部分。
涉案专利无效宣告过程中,请求人主张“实施例3中,说明书第0127段记载的对照制剂中速甾醇型按峰面积比为1.741%与表2记载的2.06%不能对应”,经双方当事人确认“表2、表3分别是速甾醇型和反式型在保存中的含量变化,但二表中的数据完全一致,表2数据属于明显错误”,如果在专利申请时对涉案专利进行了充分的核对和检查,该类错误是可以避免的。
四、总结
中国药品专利链接诉讼第一案二审判决距今已一年有余,该诉讼案件涉及的专利无效对诉讼案件的影响需引起医药行业和专利行业的深度思考。
1、从专利无效的角度,在专利无效程序中,涉及权利要求修改时,专利权人应充分考虑正在进行或者即将进行的侵权诉讼。
2、从专利申请的角度,专利申请人应充分评估说明书实施例中的方案是否能够支持权利要求的上位概括,如果不能,则需要进行相应技术方案的补充。
3、从对研发中特殊主题进行专利保护的角度,在药物研发过程中,研发人员若发现了新的杂质,可考虑对杂质进行进一步的药理或毒理学研究,若发现该杂质使得药物活性成分在药理或毒理学发生较大变化,达到需要从制剂中特意排除或者进行含量控制的地步,则可考虑针对该杂质进行相应的专利保护。
参考文献:
[1]北京知识产权法院官网,全国首例药品专利链接诉讼案入选《中国审判》2022年度十大典型案例[EB/OL](2023.2.6)[2023.12.20]https://bjzcfy.bjcourt.gov.cn/article/detail/2023/02/id/7127775.shtml
[2]医药观澜微信公众号,骨质疏松症新药「艾地骨化醇软胶囊」在中国获批上市[EB/OL](2020.12.17)[2023.12.20]https://mp.weixin.qq.com/s/61qBN_t2eQo7FYcVescxBw
[3]国家知识产权局官网,第53498号无效决定,[EB/OL](2022.1.29)[2023.12.20] https://cpquery.cponline.cnipa.gov.cn/detail/index?zhuanlisqh=UUUQ8IJCRyT3Eb8Al%252BxPLw%253D%253D
(原标题:中国药品专利链接诉讼第一案所涉专利无效对专利申请的启示)
来源:IPRdaily中文网(iprdaily.cn)
作者:郑佳 广东君龙律师事务所
张巍巍 广东君龙(坪山) 律师事务所
编辑:IPRdaily辛夷 校对:IPRdaily纵横君
注:原文链接:中国药品专利链接诉讼第一案所涉专利无效对专利申请的启示(点击标题查看原文)

「关于IPRdaily」
IPRdaily是全球领先的知识产权综合信息服务提供商,致力于连接全球知识产权与科技创新人才。汇聚了来自于中国、美国、欧洲、俄罗斯、以色列、澳大利亚、新加坡、日本、韩国等15个国家和地区的高科技公司及成长型科技企业的管理者及科技研发或知识产权负责人,还有来自政府、律师及代理事务所、研发或服务机构的全球近100万用户(国内70余万+海外近30万),2019年全年全网页面浏览量已经突破过亿次传播。
(英文官网:iprdaily.com 中文官网:iprdaily.cn)
本文来自IPRdaily中文网(iprdaily.cn)并经IPRdaily.cn中文网编辑。转载此文章须经权利人同意,并附上出处与作者信息。文章不代表IPRdaily.cn立场,如若转载,请注明出处:“http://www.iprdaily.cn”